浅谈肠炎研究:探索炎症性肠病(IBD)发病机制与治疗研究新方向
IBD是一类病因尚不明确的慢性、特发性消化道疑难杂症,主要包括溃疡性结肠炎(Ulcerative Colitis, UC)和克罗恩病(Crohn’s Disease, CD)两种疾病表型。IBD具有无法治愈、病程反复、治疗困难、好发于青壮年的特点[3]。临床上,IBD病人普遍存在腹痛、腹泻、低烧、营养不良等症状。其中,UC病人会普遍出现脓血便和局限于结肠黏膜上层的炎症、溃疡等症状[4];而CD病人可在整个消化道范围内出现慢性炎症反应,表现出肠腔狭窄、瘘管、肠梗阻等疾病表现。此外,如果IBD病人不能实现有效的疾病控制,肠道癌变的风险将随着患病年限的推移而快速上升,最终将诱发小肠和结肠癌变[5]。
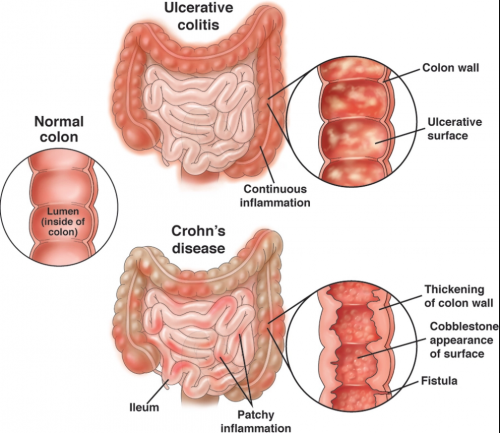
图1 UC和CD的肠道表现
诱发IBD发病的四大因素:免疫、遗传、环境、微生物
目前,针对IBD的致病机制仍然没有统一的结论。免疫、遗传、环境、微生物被普遍认为是诱发IBD发病的四大因素。
在基因层面,目前已经发现约250个基因位点与IBD有关,包括与上皮屏障、免疫反应、细胞自噬、细胞凋亡、氧化应激相关的基因[6]。这说明在IBD发病机制中存在基因与免疫系统以及肠道上皮之间的复杂关联。
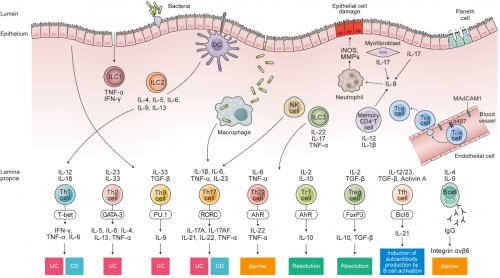
在免疫层面,IBD的慢性炎症反应与免疫系统的调节失衡和过度激活存在直接联系(图4)。一般认为,免疫系统的激活起始于结肠上皮的破损和外界抗原的入侵,最初会引起固有免疫的激活,树突细胞、巨噬细胞、嗜中性粒细胞等会参与到这个过程中。而随着免疫系统和消化道炎症的反复激活,最终将逐渐形成不可逆的慢性炎症,这主要与适应免疫的激活有关。其中,Th1和Th17细胞及其相关炎性因子的激活被认为与CD发病有关;而Th2和Th17细胞及其相关炎性因子的激活被认为与UC发病有关。此外,调节T细胞、固有淋巴细胞、B细胞等也参与到了IBD的免疫进程中[7]。
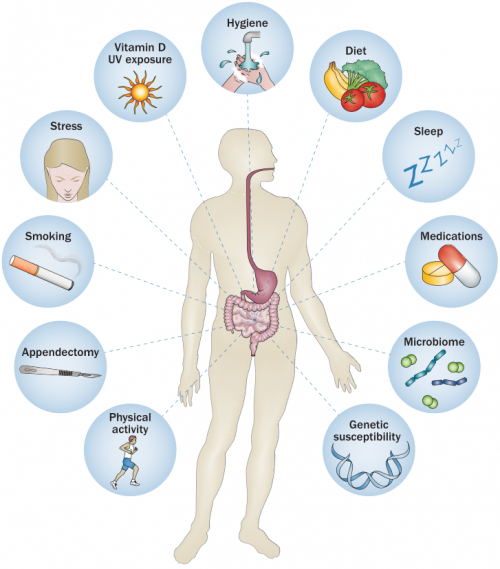
在环境层面,众多环境因素都与IBD的发病存在直接或间接的联系(图5)。城市化因素、空气污染、抗生素摄入、吸烟、消化道感染、日常饮食结构、精神压力等因素都会影响IBD的发病概率[8]。
在微生物层面,肠道菌群是维护结肠上皮微环境稳态的重要因素。目前已有大量文献表明肠道菌群的紊乱会加速IBD的疾病进展。IBD病人的肠道菌群紊乱是肠道上皮微环境恶化的表现,主要表现在菌群多样性的下降、菌群结构性的改变和潜在致病菌含量的升高[9]。肠道菌群和宿主的互作也是导致IBD疾病进展的重要因素。
综上所述,影响IBD发病的多种作用因素之间存在密切的相互关联。而这种复杂的多维度相互作用,最终形成了一个系统的IBD作用机制网络,这也给IBD发病机制的研究和临床治疗带来了巨大挑战。
尚未明确的IBD致病因素导致两种治疗研究方向
1、复杂的药物疗法
复杂的发病因素和未知的致病机制很大程度上限制了IBD的治疗。临床上针对IBD的治疗主要分为药物疗法和手术疗法两类。在药物疗法中,对过度激活的免疫系统和炎症的抑制是药物的主要作用靶点。非甾体类抗炎药物(美沙拉嗪、奥沙拉嗪)、皮质类固醇(强的松、布地奈德)、免疫抑制剂(环孢素、甲氨蝶呤)、生物制剂(英夫利昔单抗、阿达木单抗)等都被广泛的应用于IBD的疾病治疗中[10]。需要指出的是,目前还没有任何一款针对IBD治疗的特效药物,IBD的药物疗法普遍存在用药流程复杂、用药种类多等弊端。
2、无奈的手术疗法
治疗药物多为广谱类药物,多存在明显的副作用,患者对药物的耐受性较差。这也导致在全世界每年有约15%的IBD病人因为“无药可治”而被迫接受手术治疗,这意味着病人消化道的切除和生活质量的严重下降[11]。因此,复杂且治疗效果有限的治疗方案往往给IBD病人带来了严重的生理负担和心理负担。
IBD治疗研究的未来:新疗法、新药物可能推动疾病研究可行方案
尽管自工业革命第一例IBD病例报道至今已有200余年的历史,人类对IBD的认知仍然十分有限。IBD作为一种极度复杂的消化道疾病,不仅仅是单纯的炎症性疾病。学界应当从更为全面的角度理解IBD的发病过程,将微生物、干细胞、环境等因素作为IBD治疗的潜在方向和靶标。目前,在学界已经提出了粪菌移植、干细胞疗法和饮食调控等新兴的治疗手段[12]。其中,粪菌移植已经应用在临床上并取得了积极的进展。从更为全面和更新的角度进行IBD的新药研发和新疗法研发可能是推动IBD疾病研究的重要思路和可行方案。
助力IBD临床治疗研究小鼠模型推荐:
集萃药康关注自身免疫性疾病领域,打造了多种肠炎小鼠模型,并将其应用于临床前体内药效评价。
T005959 B6-IL10-KO:该品系敲除了白细胞介素10(interleukin-10,IL10)基因,小鼠在 6 月龄,可发生中轻度结肠炎。
诱导肠炎模型:集萃通过技术体系优化,可为客户提供稳定可靠的模型构建和临床前体内药效评价服务。包括DSS诱导小鼠溃疡性结肠炎模型和DNBS诱导小鼠克罗恩病模型。
参考文献
[1].Kaplan, G.G. and J.W. Windsor, The four epidemiological stages in the global evolution of inflammatory bowel disease. Nature reviews. Gastroenterology & hepatology, 2021. 18(1): p. 56-66.
[2].Alatab, S., et al., The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. The Lancet Gastroenterology & Hepatology, 2020. 5(1): p. 17-30.
[3].Kaplan, G.G. and S.C. Ng, Understanding and Preventing the Global Increase of Inflammatory Bowel Disease. Gastroenterology, 2017. 152(2): p. 313-321.e2.
[4].Ungaro, R., et al., Ulcerative colitis. Lancet, 2017. 389: p. 1756-1770.
[5].Torres, J., et al., Crohn's disease. The Lancet, 2017. 389: p. 1741-1755.
[6].Khor, B., A. Gardet and R.J. Xavier, Genetics and pathogenesis of inflammatory bowel disease. Nature, 2011. 474(7351): p. 307-317.
[7].Nakase, H., et al., The influence of cytokines on the complex pathology of ulcerative colitis. Autoimmunity Reviews, 2022. 21(3): p. 103017.
[8].Ananthakrishnan, A.N., Epidemiology and risk factors for IBD. NATURE REVIEWS GASTROENTEROLOGY & HEPATOLOGY, 2015. 12(4): p. 205-217.
[9].Imhann, F., et al., Interplay of host genetics and gut microbiota underlying the onset and clinical presentation of inflammatory bowel disease. Gut, 2017. 67(1): p. 108-119.
[10].Nakase, H., et al., Evidence-based clinical practice guidelines for inflammatory bowel disease 2020. Journal of Gastroenterology, 2021. 56(6): p. 489-526.
[11].Le Berre, C., et al., Ulcerative Colitis and Crohn's Disease Have Similar Burden and Goals for Treatment. Clinical Gastroenterology and Hepatology, 2020. 18(1): p. 14-23.
[12].Ng, S.C. and A.N. Ananthakrishnan, New approaches along the IBD course: diet, tight control and stem cells. Nat Rev Gastroenterol Hepatol, 2019. 16(2): p. 82-84.